
 |
| | ||
| In vivo | Hardware und experimenteller Aufbau | |
| Isoliertes Herz | ||
| Zellen | ||
| Extrakte | ||
|
Ausrüstung |
||

|
Alle Messungen werden in zwei vertikalen 9.4 Tesla Bruker UltraShieldTM Magneten durchgeführt (links im Bild). Die Bohrung der Magneten beträgt jeweils 89 mm. Dieser Raum steht jedoch nicht vollständig für die zu messende Probe zu Verfügung, da hier auch noch der entsprechende Probenkopf und gegebenfalls das Gradientensystem Platz finden müssen. Die Ansteuerung der mit den Magneten verbundenen Bruker AVANCE Konsolen (AVANCEIII bzw. AVANCENEO, beide nicht im Bild) erfolgt mittels Linux-PCs (ganz rechts) über ParaVision 5.1 bzw. 360 (Bildgebung) sowie TopSpin 3.0 bzw. 4.6 (hochaufgelöste Spektroskopie). Für ortsaufgelöste Messungen stehen uns wassergekühlte Microimagingsysteme mit aktiv abgeschirmten Gradienten zu Verfügung, die sich hinsichtlich Innendurchmesser (ID) und Gradientenstärke unterscheiden (Micro2.5: ID 40 mm, 1.5 Tesla/m; Mini0.5: ID 57 mm, 0.2 Tesla/m). Für in vivo Messungen stehen uns auswechselbare Resonatoren mit 10, 25, 30 und 38 mm ID sowie zwei 8-mm Solenoidspulen und eine Reihe von Oberflächenspulen zu Verfügung, die zum überwiegenden Teil "X-kernfähig" sind. |
|
|
Letzteres bedeutet, daß die Spulen nicht nur für die Detektion des 1H-Kerns sondern auch für andere Kerne (wie z.B. 2H, 13C, 19F, 23Na oder 31P – zusammengefaßt unter der Bezeichnung X-Kerne) geeignet sind. Allerdings ist selbst das reduzierte Raumangebot in den Resonatoren nicht ausschließlich für das Versuchstier reserviert. Wie an anderer Stelle noch ausführlich erläutert werden wird, ist die Registrierung des EKGs und der Atmung nicht nur zur Überwachung der vitalen Funktionen der Maus bzw. Ratte sondern auch für die Durchführung der Messungen am Herz unbedingt erforderlich. Daher müssen zusätzlich noch EKG-Elektroden, ein Atmungssensor sowie die Narkosegaszuleitung im Probenkopf mituntergebracht werden. Für Messungen an perfundierten Organen oder Zellen, bei denen keine Ortsauflösung notwendig ist, verfügen wir über eine ganze Palette von Probenköpfen, mit denen alle biologisch relevanten Kerne selektiv detektiert werden können (1H, 13C, 17O, 19F, 23Na, 31P, 87Rb, 133Cs). Die Probenköpfe sind mit Innendurchmessern von 5, 10, 20 und 30 mm sowohl für hochaufgelöste Spektroskopie an Gewebeextrakten als auch für physiologische Untersuchungen an isolierten Herzen (Maus, Ratte, Meerschweinchen) geeignet. |
||
| Nach oben |
In vivo Messungen |
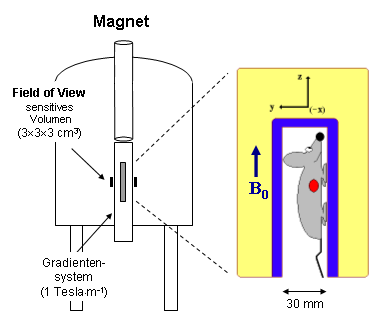
|
Für die Untersuchungen muß das Versuchstier in den Magneten im Bereich des sensitiven Volumens platziert (Skizze links) und davon überzeugt werden, dort für die Dauer der Messungen ruhig zu verweilen – was natürlich nur gelingt, wenn man das Tier narkotisiert. Dies erfolgt mittels einer Atemnaske, über die das Inhalationsnarkotikum Isofluran (1.5 % in Luft) appliziert wird. Isofluran wird auch im humanen Bereich eingesetzt und von Mäusen und Ratten gut toleriert. Etwa 1-2 Minuten nach Beendigung der MR-Untersuchungen klettern die Tiere bereits wieder munter in ihren Käfigen herum. Nach Einleiten der Narkose wird das Versuchstier vorsichtig in das Halterungssystems des Probenkopf eingebracht und dort sorgfältig fixiert (Fotos rechts), damit es während der Messungen nicht verrutschen kann. Anschließend wird der gesamte Aufbau in den Magneten überführt. |
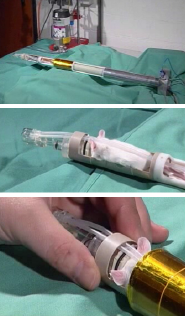
|
||
| Im Magneten werden die vitalen Funktionen (EKG, Atmung) des Tieres mittels im Probenkopf angebrachter Elektroden bzw. Sensoren überwacht und die Körpertemperatur auf 37 °C gehalten. In vorhergehenden Kontrollexperimenten haben wir uns davon überzeugt, daß die vertikale Positionierung der Tiere im Magneten keinen Einfluß auf deren normale Physiologie hat. Wenn man sieht wie die Mäuse ansonsten kopfüber in ihren Käfigen umherturnen, ist dies auch nicht zu erwarten. Bezüglich näherer Details zu den MR-Messungen sei auf die entsprechenden Seiten von Herz, Gefäßen und Gehirn verwiesen. | ||||
| Nach oben |
Messungen am isolierten Herz (Langendorff-Modell) |
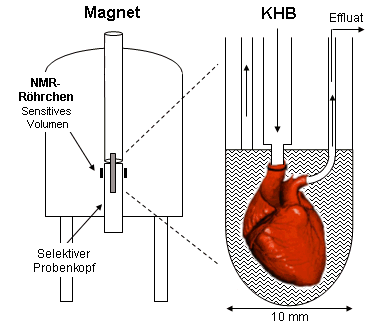
|
Untersuchungen an isoliert-perfundierten Organen haben den Vorteil, daß man hier nahezu vollständige Kontrolle über alle experimentelle Bedingungen hat. So können zum Beispiel Pharmaka unter erheblich definierteren Bedingungen direkt dem Objekt des Interesses appliziert werden, ohne daß es zu störenden Interaktionen mit dem Blutkreislauf oder anderen Organen kommt. |
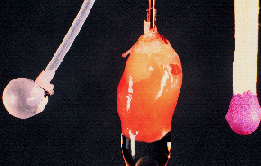
|
||
|
Das Herz eignet sich für solche Untersuchungen besonders gut, da es auch außerhalb des Körpers sofort wieder munter zu schlagen beginnt, wenn es nur ausreichend mit Sauerstoff, Brennmaterial (wie Glukose oder Fettsäuren) und ein paar essentiellen Ionen wie Ca2+, K+ und Na+ versorgt wird. Allerdings erfordert die Präparation und das "Aufhängen" des kleinen Mäuseherzens an der Perfusionskanüle ein gewisses Fingerspitzengefühl (zum Größenvergleich ganz rechts ein normales Streichholz). Links neben dem Herz ist ein wassergefüllter Ballon zu erkennen, der zur Erfassung der Pumpfunktion in die linke Herzkammer eingeführt wird. |
||||

|
Die Perfusion und die adäquate Versorgung des Herzens erfolgt über die Aorta (vgl. die Abbildungen rechts oben und links) mit einer speziellen Pufferlösung, (Krebs-Henseleit Buffer, KHB) bei einem physiologischen Druck von 100 mmHg. Das Herz wird dann mit einer ganzen Menge von Kabeln zur Erfassung der funktionellen Parameter in ein 10-mm-NMR-Röhrchen überführt und anschließend – genauso wie die narkotisierte Maus – im sensitiven Volumen des Magneten (siehe rechts oben) bei 37 °C platziert. Ein langer schwarzer Rüssel (nebenstehendes Bild) sorgt dafür, daß das Herz auch im Innern des Magneten entsprechend seines Bedarfes versorgt wird. In der Mitte des Fotos erkennt man das Pufferreservoir sowie eine Reihe von Pumpen, die sicherstellen, daß die Flüssigkeit im NMR-Röhrchen nicht überläuft. Ganz rechts schließt sich dann noch der Meßturm zur Bestimmung physiologischer Variablen an. Routinemäßig werden neben den über die NMR-Spektroskopie zugänglichen Größen (vgl. Energetik, Stoffwechsel und Myoglobin) folgende Parameter erfaßt: der linksventrikulär entwickelte Druck (LVDP), die Druckanstiegsgeschwindigkeit (dP/dt), die Herzfrequenz, der koronare Fluß sowie der myokardiale Sauerstoffverbrauch. Des weiteren erhält man durch die Untersuchung des Effluats Auskunft über Substanzen, die vom Herzen unter Streßsituationen (wie z.B. Sauerstoffmangel) als Botenstoffe freigesetzt werden. |
|||
| Nach oben |
Messungen an perfundierten Zellen |

|
Die oben beschriebene Beschränkung auf ein einzelnes Organ vereinfacht bereits vieles, läßt aber durch die Heterogenität des Gewebes trotz allem nur die Detektion der Summe aller metabolischen Vorgänge der vorhandenen Zelltypen zu (im Herzen z.B. Endothel- und Muskelzellen). Dies hat zur Folge, daß Zellen mit verschiedenen Funktionen – und damit oft unterschiedlichen Charakteristiken im Stoffwechsel – nicht differenziert werden können. Demgegenüber erlaubt die Verwendung perfundierter Zellkulturen den individuellen Metabolismus einzelner Zelltypen kontinuierlich zu beobachten und zu charakterisieren. Um eine zufriedenstellende Zeitauflösung bei der Aufnahme der NMR-Spektren zu erhalten, wird eine relativ große Zellzahl (etwa 108) in einem kleinen Volumen (ca. 1 cm3) benötigt. Dies läßt sich bei der Untersuchung von in Suspension wachsenden Zellen (z.B. Lymphozyten) relativ problemlos realisieren. Um diese großen Zellzahlen auch bei adhärent wachsenden Kulturen (wie z.B. Endothel- und Muskelzellen) zu erreichen, ist es notwendig, die im Probenvolumen zu Verfügung stehende Wachstums- bzw. Anheftungsfläche zu maximieren. Hierfür können microcarrier beads (kleine beschichtete Kugeln), Dialyse-Membranen, hollow fiber bioreactors (speziell entwickelte Brutreaktoren) sowie Agarose- bzw. Basalmembrangel-Fäden benutzt werden. Ganz ähnlich wie oben für das isolierte Herz beschrieben, werden die Zellen zur Messung in ein NMR-Röhrchen überführt und im Magneten bei 37 °C mit einer Perfusionsapparatur versorgt. Auch hier verhindern Absaugpumpen eine Überflutung des Probenkopfes. Da die Zellen nicht "aufgehängt" sind, muß durch eine poröse Scheibe dafür Sorge getragen werden, daß die Zellen im sensitiven Volume zurückgehalten werden (vgl. nebenstehende Abbildung). |
| Nach oben |
Hochaufgelöste Messungen an Gewebeextrakten |
|
Was spricht überhaupt dafür, NMR-Untersuchungen an Gewebeextrakten durchzuführen, wenn man dabei die beiden Haupttrümpfe der MR-Methode – nämlich die Nichtinvasivität und die Möglichkeit repetitiver Messungen an ein und demselben Objekt – über Bord wirft? Opfert man die zeitliche Dynamik, so eröffnet die Messung von absolut homogenen Proben über einen erheblich längeren Zeitraum jedoch experimentelle Perspektiven, die ansonsten nahezu unmöglich zu realisieren sind:
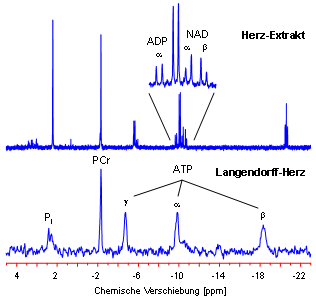
Nebenstehende Abbildung gibt ein Beispiel für die erhöhte spektrale Auflösung, die man beim Übergang vom perfundierten Organ (unten) zum Gewebeextrakt (oben) gewinnt – offensichtlich bleiben im unteren Spektrum eine ganze Reihe von Details verborgen. |
|
|
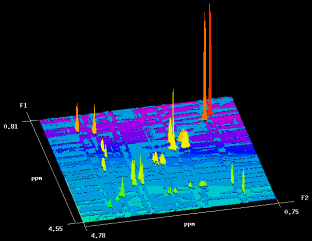
Trotz der reduzierten Linienbreite der Signale in den Extraktspektren kann es trotz allem noch zu Signalüberlagerungen kommen, die die Zuordnung und Auswertung erschweren. Diese lassen sich jedoch durch 2D-Korrelationsexperimente (z.B. H-H, C-H) auflösen. Auf der linken Seite ist exemplarisch ein 2D-H,H-TOCSY (Total Correlation Spectroscopy) eines Herzextraktes abgebildet. Die direkten H-H-Kopplungen (Theorie) erscheinen hier als Crosspeaks auf der F1- und F2-Achse, während das normale 1D-Spektrum entlang der Diagonalen wiederzufinden ist. Insgesamt liefert die hochaufgelöste Spektroskopie von Gewebeextrakten also reichhaltig Informationen, die die in vivo Messungen sinnvoll ergänzen. Es soll jedoch nicht unerwähnt bleiben, daß hierfür eine adäquate Aufarbeitung der Proben vonnöten ist. Das Gewebe muß sofort nach Entnahme mit flüssigem Stickstoff schockgefroren werden, um alle metabolischen Prozesse schlagartig zu stoppen. Anschließend erfolgt dann die Extraktion mit starken Säuren (z.B. Perchlorsäure), die die cytosolischen Komponenten zugänglich macht und gleichzeitig alle Proteine denaturiert. |
|
||||