
 |
| | ||
| Das Molekül | Myoglobin | |
| 1H-NMR | ||
| NO | ||
| Publikationen | ||
|
Das Molekül |
||||
|
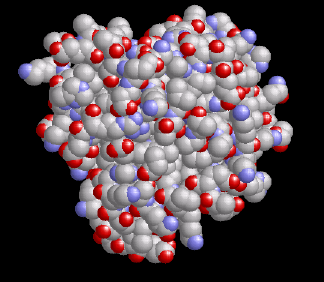
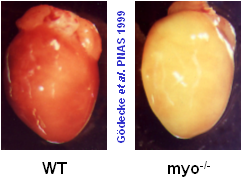
Myoglobin ist ein kleines, globuläres Hämoprotein aus 153 Aminosäuren (Mr ~17000 Da), das bis zu einer Konzentration von 0.5 mM im Cytosol der Skelett- (Typ I und IIa) und Herzmuskulatur vorkommt. Myoglobinhaltige Muskeln sind rot, wie rechts am Beispiel eines normalen Mäuseherzens (WT=Wildtyp) gezeigt; ist der Myoglobingehalt reduziert, z.B. im Geflügelfleisch, oder fehlt das Myoglobin aufgrund einer genetischen Manipulation vollständig (myo-/-, Abbildung rechts außen), erscheinen die Muskelfasern erheblich blasser.
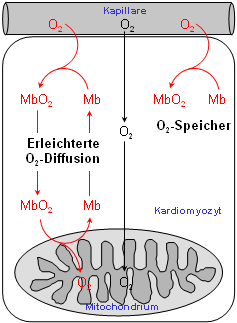
Ähnlich wie das verwandte Hämoglobin, das den O2-Transport von der Lunge zu den Zellen bewerkstelligt, bindet das Myoglobin reversibel O2 – allerdings mit einer sechsfach höheren Affinität als das im Blutkreislauf zirkulierende Hämoglobin. Dadurch kann es den vom Hämoglobin in der Kapillare bereitgestellten O2 leicht übernehmen. O2 bindet an das zentrale Eisenatom der Hämgruppe (in der linken Abbildung orange markiert, vergleiche auch den 1H-NMR-Abschnitt). Für das nun gebildete Oxymyoglobin wurden bislang drei verschiedene Funktionen vorgeschlagen:
|
|
||
 Funktionen von Myoglobin
Funktionen von Myoglobin
|
||||
|
Während die Funktion von Myoglobin als O2-Reservoir allgemein akzeptiert ist – was insbesondere durch den bis zu zehnfach höheren Myoglobingehalt in Muskeln von tauchenden Säugetieren, wie Delphinen und Walen, gestützt wird – waren die beiden anderen Funktionen aufgrund der widersprüchlichen Datenlage lange umstritten. Dem gesamten Forschungsgebiet wurde jedoch vor wenigen Jahren durch die Erzeugung Myoglobin-defizienter Mäuse (siehe Abbildung rechts oben) in unserer und einer amerikanischen Arbeitsgruppe frisches Leben eingehaucht. Durch Vergleich der Myoglobin-Verlustmutante mit normalen Kontrolltieren konnten wir zeigen, daß Myoglobin in der Tat eine wichtige Rolle bei der erleichterten O2-Diffusion im Herzen zukommt, und daß demgegenüber die Myoglobin-vermittelte oxidative Phosphorylierung, wenn überhaupt, nur eine untergeordnete Bedeutung besitzt (Merx et al, 2001).
Darüber hinaus konnten wir überraschenderweise zwei wichtige neue Funktionen von Myoglobin im Stoffwechsel des Muskels entdecken: Die Fähigkeit von Myoglobin, sowohl Stickstoffmonoxid (NO) als auch freie Sauerstoffradikale effektiv abzubauen (vgl. auch die unten angebenen Originalarbeiten). Für alle diese Untersuchungen war die nichtinvasive Messung des Myoglobins im Herzen mittels 1H-NMR-Spektroskopie von entscheidender Bedeutung (siehe den nächsten Abschnitt). |
||||
| Nach oben |
1H-NMR-Spektroskopie des Valins 68 |
|
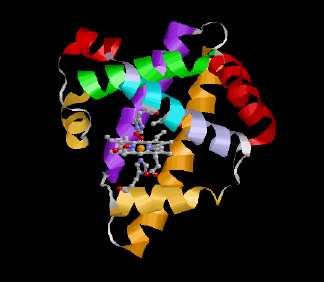
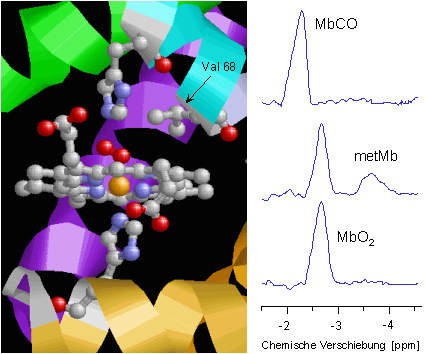
Die nebenstehende Abbildung zeigt noch einmal im Detail die strukturellen Verhältnisse an der Hämgruppe des Myoglobins. Das zentrale Eisenatom (orange) ist in der Ebene des Porphyrinrings von vier Stickstoffatomen (blau) umgeben. Die untere Koordinationsstelle wird von einem weiteren Stickstoff (des "proximalen" Histidins, His93 oder F8) besetzt, während die O2-Bindung oberhalb der Ringebene erfolgt. Die Bindung des O2 wird durch eine Wasserstoffbrückenbindung zum "distalen" Histidin (His64 oder E7) zusätzlich stabilisiert. In unmittelbarer Nachbarschaft dazu erkennt man die Methylgruppen des Valin 68 (E11), deren Protonen als Reporterkerne für die aktuelle Situation am Häm genutzt werden können.
Bei adäquater O2-Versorgung des Herzgewebes liegt das Myoglobin infolge seiner hohen O2-Affinität vollständig oxygeniert vor (MbO2). In dieser Form erhält man für die Protonen des Valins im 1H-NMR-Spektrum des Herzens ein Signal bei -2.7 ppm (siehe die untere Spur). Nur bei einem Ungleichgewicht zwischen O2-Angebot und Verbrauch kommt es zu einer Deoxygenierung des Myoglobins und somit zu einer Abnahme der Intensität des MbO2-Signals. Insofern läßt sich aus der Stärke dieses Signals auf den aktuellen Stand der myokardialen O2-Versorgung schließen. Über einen einfachen mathematischen Zusammenhang kann man daraus auch den intrazellulären O2-Partialdruck der Herzmuskelzellen berechnen – eine Größe, die mit anderen Methoden nur sehr schwer zugänglich ist. |
|
|
Der Oxygenierungsgrad ist jedoch nicht der einzige Parameter, der das Signal für die Protonen des Valins im 1H-NMR-Spektrum beeinflußt. Ganz allgemein führen Veränderungen an der chemischen bzw. elektronischen Situation am Häm zu Änderungen von Intensität und Lage dieses Signals. Verdrängt zum Beispiel das giftige CO aufgrund seiner höheren Affinität zum Eisen den gebundenen O2, so spiegelt sich das entstehende MbCO im Spektrum durch ein Signal bei -2.3 ppm wider (obere Spur). Neben einem Ligandenaustausch beeinflußt auch der Oxidationsstatus des Eisens das Protonensignal: Verliert das Eisen im Myoglobin beispielsweise ein Elektron und geht vom normalerweise zweiwertigen in den dreiwertigen Zustand – üblicherweise als Metmyoglobin (metMb) bezeichnet – über, so läßt sich der Anteil des gebildeten metMb anhand seines Signals bei -3.8 ppm eindeutig nachweisen (mittlere Spur, vergleiche auch den nächsten Abschnitt über Myoglobin und Stickstoffmonoxid).
Insgesamt lassen sich also über die 1H-NMR-spektroskopisch sensitiven Reporterprotonen des Valins vielfältige Informationen über die Situation an der Hämgruppe des Myoglobins gewinnen (Oxygenierung, Ligandenbindung, Redoxstatus), die wiederum den aktuellen metabolischen Zustand des Herzens reflektieren. |
||
| Nach oben |
Myoglobin und Stickstoffmonoxid |
|
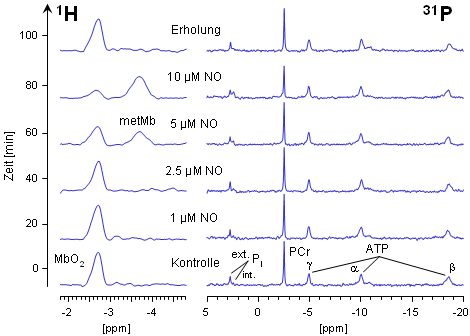
Die nebenstehende Abbildung zeigt 1H- und 31P-NMR-Spektren eines Wildtyp-Herzens (WT), dem kontinuierlich immer größer werdende Mengen von Stickstoffmonoxid (NO) über die Koronargefäße zugeführt wurden. Aus den unteren beiden Spuren ist ersichtlich, daß NO-Konzentrationen bis zu 1 µM keinerlei Auswirkungen auf die Oxygenierung des Myoglobins bzw. auf den Energiestatus des Herzens haben. Steigert man jedoch die infundierte NO-Menge, kommt es ≥ 2.5 µM zu einem Abfall des MbO2-Signals bei -2.7 ppm. Gleichzeitig läßt sich ein zusätzliches Signal bei -3.8 ppm detektieren, daß zweifelsfrei dem metMb zugeordnet werden kann (siehe oben).
Erhöht man die NO-Konzentration noch weiter, wird das MbO2 nahezu vollständig in metMb überführt (siehe die quantitative Auswertung dieses Experiments). Diese Reaktion ist jedoch nach Beendigung der NO-Infusion reversibel (oberste Spur), was die rasche Regenerierung des MbO2 durch die metMb-Reduktase widerspiegelt (vergleiche das Schema weiter unten). Bemerkenswert ist, daß die Umwandlung von MbO2 in metMb bereits bei NO-Konzentrationen nachweisbar ist, bei denen in den 31P-NMR-Spektren noch keinerlei Anzeichen für eine Beeinträchtigung des Energiestatus bemerkbar sind. |
|
| Vergleicht man nun in einem weiteren Experiment die dosisabhängigen Effekte von NO auf die Funktion und Energetik von WT bzw. Myoglobin-defizienten (myo-/-) Herzen, so erkennt man, daß genau in dem Konzentrationsbereich, in dem im WT die Umwandlung von MbO2 in metMb erfolgt, myo-/--Herzen empfindlicher auf gleiche Mengen infundierten NOs reagieren (siehe die quantitative Auswertung dieses Experiments). Dies spiegelt sich sowohl in einer stärkeren Einschränkung der linksventrikulären Druckentwicklung (LVDP) als auch des Energiestatus (verminderte PCr- und erhöhte ADP-Spiegel) wider. In weiteren Untersuchungen zeigte sich, daß das Fehlen des Myoglobins nicht nur zu einer erhöhten Sensitivität des Herzens auf die exogene Gabe von NO sondern auch auf die endogene Stimulation der endothelialen NO-Synthase (eNOS) mittels Bradykinin führt (vgl. Flögel et al, 2001). Diese Befunde legen den Schluß nahe, daß es in Gegenwart von Myoglobin offenbar zu einer substantiellen Inaktivierung des bioaktiven NOs kommt. | ||
|
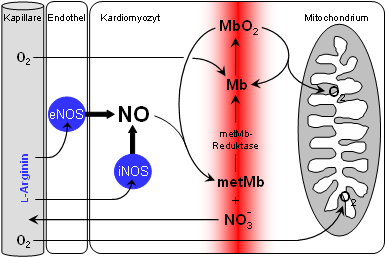
Dies läßt sich zwanglos mit bereits lange bekannten chemischen Reaktionen von Myoglobin und NO (siehe das Schema auf der rechten Seite) in Einklang bringen, die zwar im Reagenzglas schon ausführlich untersucht worden sind, von denen aber bis jetzt nicht klar war, daß sie von physiologischer Relevanz sind. Offensichtlich ist die Reaktion von MbO2 + NO → metMb + Nitrat ein "chemischer Staubsauger", der dafür sorgt, daß selbst bei erhöhter NOS-Aktivität die cytosolischen NO-Spiegel extrem niedrig gehalten und so schädigende Einflüsse der NO-Radikale auf die Atmungskette vermieden werden können.
Von entscheidender Bedeutung für die Wirksamkeit dieses Staubsaugers ist die Aktivität der metMb-Reduktase, die dafür sorgt, daß gebildetes metMb wieder in MbO2 überführt wird und für einen neuen Zyklus zur Verfügung steht. Diese molekulare "Firewall" arbeitet so effizient, daß überraschenderweise selbst eine massiv gesteigerte NO-Produktion durch eine Überexpression der induzierbaren NO-Synthase (iNOS) neutralisiert werden kann. |
|
|
| Erst wenn man parallel dazu durch pharmakologische oder genetische Intervention das Myoglobin ausschaltet, zeigt sich der negative Einfluß permanent erhöhter NO-Mengen, der sich ähnlich wie oben in einer geschränkten Funktion und Energetik manifestiert und letztendlich bis zum Herzversagen führen kann (vgl. die nachstehenden Originalarbeiten). Zusammenfassend läßt sich aus diesen Experimenten ableiten, daß Myoglobin eine zentrale Rolle in der Inaktivierung von NO zukommt und eine effektive Barriere zum Schutz des Herzens vor nitrosativem Stress bildet. Dies stellt –- neben den weiter oben beschriebenen Funktionen wie O2-Speicher und -Transport – eine neue, bislang im Verborgenen gebliebene physiologische Funktion dieses altbekannten Proteins dar. | ||
| Nach oben |
Eigene Arbeiten zum Myoglobin |
| Eine vollständige Übersicht über die in den letzten Jahren von uns publizierten Arbeiten finden Sie hier. Die Literaturstellen sind verlinkt mit den PubMed-Abstracts der National Library of Medicine. Wenn Sie Interesse an einer dieser Arbeiten und keinen Online-Zugang zu der entsprechenden Zeitschrift haben, senden Sie uns eine Email, damit wir Ihnen eine PDF-Datei zukommen lassen können. |
| Methodische Arbeiten |
| Flögel U, Merx MW, Gödecke A, Decking UK, Schrader J. |
| Myoglobin: A scavenger of bioactive NO. |
| Proc Natl Acad Sci USA. 2001; 98: 735-40. |
| Merx MW, Flögel U, Stumpe T, Gödecke A, Decking UK, Schrader J. |
| Myoglobin facilitates oxygen diffusion. |
| FASEB J. 2001;15: 1077-9. |
| Übersichtsarbeiten und Kommentare |
| Flögel U, Fago A, Rassaf T. |
| Keeping the heart in balance: the functional interactions of myoglobin with nitrogen oxides. |
| J Exp Biol. 2010; 213: 2726-33. |
| Hendgen-Cotta UB, Flögel U, Kelm M, Rassaf T. |
| Unmasking the Janus face of myoglobin in health and disease. |
| J Exp Biol. 2010; 213: 2734-40. |
| Flögel U, Dang CV. |
| Myoglobin tames tumor growth and spread. |
| J Clin Invest. 2009; 119: 766-8. |
| Anwendungen |
| Hendgen-Cotta UB, Esfeld S, Coman C, Ahrends R, Klein-Hitpass L, Flögel U, Rassaf T, Totzeck M. |
| A novel physiological role for cardiac myoglobin in lipid metabolism. |
| Sci Rep. 2017; 7: 43219 (13 pages). |
| |
| Flögel U, Jacoby C, Gödecke A, Schrader J. |
| In vivo 2D mapping of impaired murine cardiac energetics in NO-induced heart failure. |
| Magn Reson Med. 2007; 57: 50-8. |
| Rassaf T, Flögel U, Drexhage C, Hendgen-Cotta U, Kelm M, Schrader J. |
| Nitrite reductase function of deoxymyoglobin: oxygen sensor and regulator of cardiac energetics and function. |
| Circ Res. 2007; 100: 1749-54. |
| Flögel U, Laussmann T, Gödecke A, Abanador N, Schäfers M, Fingas CD, Metzger S, Levkau B, Jacoby C, Schrader J. |
| Lack of myoglobin causes a switch in cardiac substrate selection. |
| Circ Res. 2005; 96: e68-75. |
| Merx MW, Gödecke A, Flögel U, Schrader J. |
| Oxygen supply and nitric oxide scavenging by myoglobin contribute to exercise endurance and cardiac function. |
| FASEB J. 2005; 19: 1015-7. |
| Flögel U, Gödecke A, Klotz LO, Schrader J. |
| Role of myoglobin in the antioxidant defense of the heart. |
| FASEB J. 2004; 18: 1156-8. |
| Wunderlich C, Flögel U, Gödecke A, Heger J, Schrader J. |
| Acute inhibition of myoglobin impairs contractility and energy state of iNOS-overexpressing hearts. |
| Circ Res. 2003; 92: 1352-8. |
| Gödecke A, Molojavyi A, Heger J, Flögel U, Ding Z, Jacoby C, Schrader J. |
| Myoglobin protects the heart from inducible nitric-oxide synthase iNOS-mediated nitrosative stress. |
| J Biol Chem. 2003; 278: 21761-6. |
| Gödecke A, Flögel U, Zanger K, Ding Z, Hirchenhain J, Decking UK, Schrader J. |
| Disruption of myoglobin in mice induces multiple compensatory mechanisms. |
| Proc Natl Acad Sci USA. 1999; 96: 10495-500. |
|
||||