Analyse des Substratmetabolismus
|
|
Zur Bereitstellung der für die regelmäßige Herzarbeit notwendigen Energie ist eine ständige Neusysnthese des verbrauchten ATPs notwendig. Hierzu werden hauptsächlich Zucker und Fettsäuren verbrannt, wobei ein gesundes Herz normalerweise etwa zu einem Drittel Glucose und zu zwei Drittel Palmitinsäure zur Energieproduktion nutzt. Allerdings kommt es bei einigen Herzerkrankungen – insbesondere bei einer Hypertrophie, sprich Herzverdickung infolge von hoher Belastung – zu einer Verschiebung dieses Verhältnisses von 1:3 und zu einer verstärkten Verstoffwechselung von Glucose.
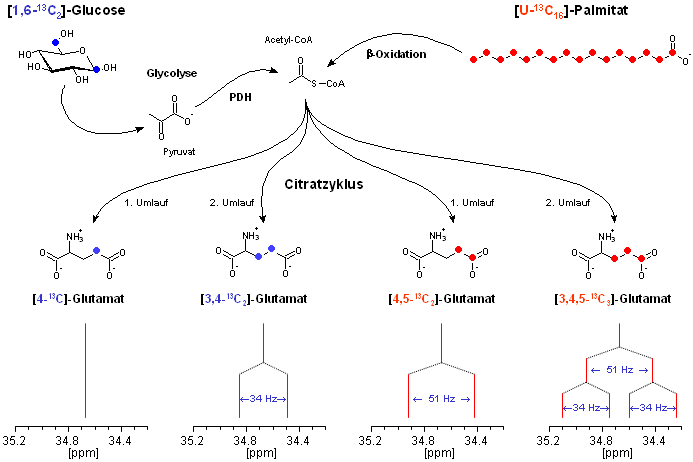
Ein solcher Substratshift läßt sich experimentell sehr elegant durch eine Isotopomerenanalyse mittels 13C-NMR-Spektroskopie nachweisen, wobei man sich die Kopplungsmuster benachbarter 13C-Atome zunutze macht. Das Prinzip dieser Methode ist in untenstehender Abbildung schematisch dargestellt und nachfolgend kurz erläutert.
|
|
|
Man läßt das Herz Substrate verbrennen, bei denen an geeigneten Stellen im Molekül das normale Kohlenstoffisotop 12C durch das natürlich nur zu weniger als 1% vorkommende Isotop 13C (im Gegensatz zu 14C nicht radioaktiv) ersetzt ist. Die ausgetauschten Atome sind für die Glucose blau bzw. für die Palmitinsäure rot gekennzeichnet.
Durchlaufen diese Substrate die normalen Stoffwechselwege (erst die Glykolyse, dann den Citratzyklus) landet die Markierung schließlich – in Abhängigkeit vom Ausgangssubstrat und der Zahl der Umläufe im Citratzyklus – an unterschiedlichen Positionen im Kohlenstoffgerüst des Glutamats.
Wer mehr wissen will, kann durch Clicks auf Glucose bzw. Palmitat die Markierung dieser Moleküle durch den Stoffwechsel und das Entstehen der verschiedenen Isotopomere des Glutamats im Detail verfolgen.
|
|
Die unterschiedlichen Nachbarschaftsverhältnisse der 13C-Kerne in den jeweiligen Glutamatisotopomeren spiegeln sich in eindeutigen Kopplungsmustern im 13C-NMR-Spektrum wider (vgl. obige Abbildung): eine Monomarkierung ergibt ein Singulett, eine Doppelmarkierung ein Dublett und eine Tripelmarkierung ein Dublett von Dublett bzw. ein Quartett. Bemerkenswert ist, daß man aufgrund der unterschiedlichen Kopplungskonstanten (abgekürzt mit J, vgl. auch Theorie) sogar unterscheiden kann, ob die Doppelmarkierung an C3+C4 (J34=34 Hz) oder an C4+C5 (J45=51 Hz) des Glutamats vorliegt. Damit läßt sich zweifelsfrei feststellen, aus welchem Ausgangssubstrat die einzelnen Isotopomere gebildet worden sind, und somit Veränderungen im Substratstoffwechsel nachweisen (siehe unten).
|
Nach oben |
Veränderungen im Substratstoffwechsel
|
|
|
|
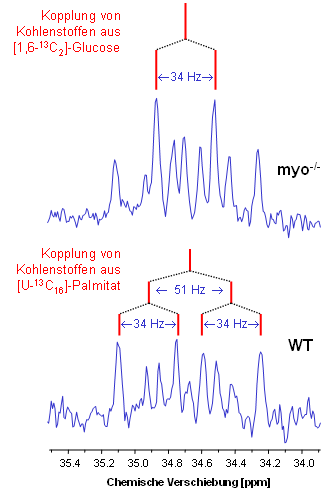
Die Abbildung links zeigt den Bereich des Glutamat-C4 aus 13C-NMR-Spektren von Herzgewebe, das aus normalen, gesunden Mäusen (unten, WT=Wildtyp) entnommen wurde bzw. von Mäusen, denen das Hämoprotein Myoglobin fehlt (oben, myo-/-). Vergleicht man die Signale in den Spektren mit den oben dargestellten Schemata der Kopplungen, so findet man in beiden Fällen die Muster für die vier denkbaren Isotopomeren des Glutamats wieder. Es fällt jedoch auf, daß sich das Verhältnis der Signale, die von der Verstoffwechselung der beiden verschiedenen Substrate herrühren, deutlich unterscheiden.
|
|
|
|
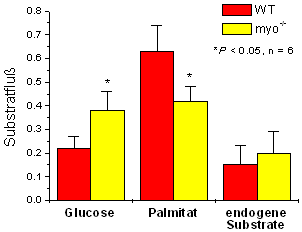
Während oben vor allem die Muster, die durch die Verbrennung von Glucose hervorgerufen werden, ins Auge stechen, überwiegen im unteren Spektrum die Signale, die auf die Verwendung von Palmitat schließen lassen. Die quantitative Auswertung (Abbildung rechts) zeigt eindeutig, daß das Fehlen des Myoglobins zu einer Verschiebung des normalen Verbrennungs-Verhältnisses von 1:3 (Glucose:Fettsäure) zu einer etwa gleichen Nutzung der beiden Substrate führt – ein Shift, den man auch während der Ausbildung einer Hypertrophie im Menschen beobachtet (siehe oben).
Allerdings zeigen Myoglobin-defiziente Mäuse trotz des Fehlens dieses O2-Trägerproteins (O2=Sauerstoff) erstaunlicherweise keinerlei Anzeichen einer Herzerkrankung. Dies ist auf die Ausbildung einer ganzen Reihe von Kompensationsmechanismen zurückzuführen, die alle darauf ausgerichtet sind, die Störung in der O2-Versorgung abzupuffern, wie z.B Erhöhungen in der Kapillardichte, des koronaren Flußes, der Koronarreserve und des Hämatokrits (vgl. Gödecke et al, 1999). Dadurch wird das O2-Angebot auf der vaskulären Seite erhöht, der O2-Gradient von der Kapillare zu den Mitochondrien gesteigert und somit die Diffusion des O2 vom Gefäß zum Ort der Verbrennung erleichtert.
|
|
Parallel dazu wirkt der mittels 13C-NMR-Spektroskopie nachgewiesene Substratshift als biochemischer O2-Sparmechanismus auf der Verbraucherseite: Es ist bekannt, daß zur Verbrennung von Glucose deutlich weniger O2 verbraucht wird als bei der Verbrennung von Fettsäuren – bei Bildung gleicher Mengen von ATP. Somit kompensieren die Myoglobin-defizienten Herzen durch vermehrte Verwendung des oxidativ günstigeren Substrates, nämlich von Glucose, den Verlust des O2-Träger- und -Speicherproteins Myoglobin (für eine ausführlichere Darstellung und Diskussion der Ergebnisse vgl. Flögel et al, 2005).
|
Nach oben |
Eigene Arbeiten zum Substratstoffwechsel
|
|
| Eine vollständige Übersicht über die in den letzten Jahren von uns publizierten Arbeiten finden Sie hier. Die Literaturstellen sind verlinkt mit den PubMed-Abstracts der National Library of Medicine. Wenn Sie Interesse an einer dieser Arbeiten und keinen Online-Zugang zu der entsprechenden Zeitschrift haben, senden Sie uns eine Email, damit wir Ihnen eine PDF-Datei zukommen lassen können. |
| |
| Methodische Arbeiten |
| |
| Flögel U, Laussmann T, Gödecke A, Abanador N, Schäfers M, Fingas CD, Metzger S, Levkau B, Jacoby C, Schrader J. |
| Lack of myoglobin causes a switch in cardiac substrate selection. |
| Circ Res. 2005; 96: e68-75. |
| |
| Flögel U, Willker W, Leibfritz D. |
| Determination of de novo synthesized amino acids in cellular proteins revisited by 13C NMR spectroscopy. |
| NMR Biomed. 1997; 10: 50-8. |
| |
| Anwendungen |
| |
| Waclawczyk S, Buchheiser A, Flögel U, Radke TF, Kögler G. |
| In vitro differentiation of unrestricted somatic stem cells into functional hepatic-like cells displaying a hepatocyte-like glucose metabolism. |
| J Cell Physiol. 2010; 225: 545-54. |
|
| Flögel U, Leibfritz D. |
| Alterations in glial cell metabolism during recovery from chronic osmotic stress. |
| Neurochem Res. 1998; 23: 1553-61. |
| |
| Willker W, Flögel U, Leibfritz D. |
| Ultra-high-resolved HSQC spectra of multiple 13C-labeled biofluids. |
| J Magn Reson. 1997; 125: 216-9. |
| |
| Flögel U, Willker W, Engelmann J, Niendorf T, Leibfritz D. |
| Adaptation of cellular metabolism to anisosmotic conditions in a glial cell line, as assessed by 13C NMR spectroscopy. |
| Dev Neurosci. 1996; 18: 449-59. |
| |




